Con información de la UNAM
Hay moléculas que podrían emplearse para describir el curso de la civilización humana: el agua pura, el azúcar de caña, la sal, o más recientemente la aspirina, o la penicilina. La ingeniería genética, herramienta cuyo desarrollo celebramos en este número, irrumpió en el mundo moderno aportando una de esas moléculas que caracterizan esta era: la insulina (Figura 1).
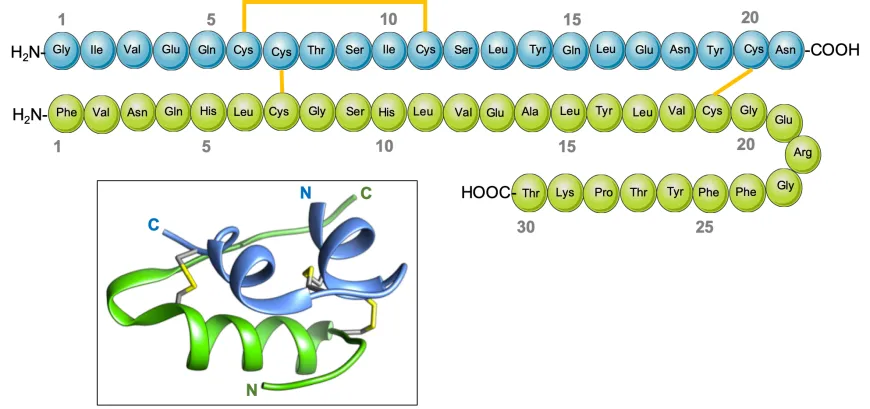
Biotecnología moderna, bioseguridad y los orígenes terapéuticos de la diabetes
El 29 de octubre de 2022 se cumplieron 40 años de un nuevo parteaguas en la historia de la biotecnología que abrió paso a la biotecnología moderna: la aprobación por parte de la FDA (la Food and Drug Administration en los EUA) de la insulina humana producida por una bacteria modificada genéticamente a través de técnicas de ADN recombinante para el tratamiento de la diabetes. La aprobación, que fue dada a conocer en la primera plana de los periódicos como el New York Times (Figura 2), solo tomó 5 meses. Henry Miller, director fundador de la Oficina para Biotecnología de la FDA, reseña esta historia en una publicación reciente (1). Destaca la decisión de que no se requería de nuevos paradigmas regulatorios para evaluar a la insulina recombinante, al considerar que la tecnología del ADN recombinante era solo una extensión o refinamiento de métodos tradicionales de producción de medicamentos por microorganismos.

En 1922, 60 años antes de la aprobación de la insulina por la FDA se otorgó el Premio Nobel de Fisiología y Medicina a Frederick Grant Banting y a John James Richard Macleod. Ese mismo año, Banting y Charles Best lograron producir insulina de cerdo cruda a partir del páncreas, en realidad de restos de cerdos y vacas provenientes de la industria empacadora de carne, dando inicio al tratamiento terapéutico de la diabetes (Figura 3). Este acontecimiento lo evoca Martin Scorsese en la película “Los Asesinos de la Luna”, (Killers of the Flower Moon) de reciente estreno, cuando diabéticos de la tribu Osage al noreste de Oklahoma de pronto disponen de insulina.
Como suele suceder, hubo numerosas protestas de otros científicos que reclamaban ser incluidos en el reconocimiento, incluido el propio Charles Best, también ignorado por los jurados suecos (2).

Al margen de la disputa por los honores, el trabajo de búsqueda/concentración/purificación de Banting y Best fue espectacular: de acuerdo con información publicada en el Blog del National Museum of American History (3), se requería de poco más de una tonelada de residuos de cerdos para obtener alrededor de 100g de insulina pura de puerco (Figura 4). De continuar esta tendencia, los 778 millones de cerdos que se producen al año en el mundo actualmente (58% en China), no hubieran alcanzado para tratar a los 570 millones de diabéticos.

Hoy la industria de medicamentos obtenidos por ingeniería genética es el sector económicamente más importante de la Industria farmacéutica. De acuerdo con el portal Drug Discovery and Devlopment (4), dentro de los 50 medicamentos con ventas por arriba de los dos mil millones de dólares en 2022, los cinco primeros son productos recombinantes o transgénicos, con la vacuna contra Covid-19 de Pfizer/BioNTech Comirnaty con ventas de casi 56 mil millones de dólares a la cabeza. En un redituable lugar número 49 en ventas se encuentra la insulina de acción prolongada (Lantus), producida por Sanofi, con ventas de 2 mil 343 millones de dólares. Si bien se enlistan por valor en el mercado, sería fantástico poder priorizarlas diseñando un índice que cuantificara y mostrara a la sociedad las vidas salvadas, el sufrimiento evitado o la calidad de vida ganada. Como sea, estos datos son evidencia concreta no solo del gran impacto de la Biotecnología Moderna en la sociedad, sino también de la seguridad de sus productos y vigilancia a la que han estado sujetos.
El IBt, la UNAM y la Biotecnología Moderna
La puerta que la ingeniería genética representa para que productos de genes de cualquier origen accedan a las farmacias primero y a las despensas posteriormente, vía su expresión en la bacteria Escherichia coli, se abre en la Universidad de California en San Francisco (UCSF) con los trabajos de Stanley Cohen, Herbert Boyer y colaboradores (5) y posteriormente de Goeddel y colaboradores (6) y de Francisco Bolívar, también con Herbert Boyer, y otros colaboradores (7) a través de la construcción de verdaderos vehículos moleculares, concretamente, plásmidos que entran a la célula hospedera, transportando genes de cualquier tipo de célula.
De hecho, el trabajo de Francisco Bolívar que describe el plásmido pBR322, un vehículo de clonación multipropósito, constituye el pilar sobre el que se sientan las bases de cientos de proyectos en el mundo para la producción de proteínas recombinantes en E. coli, estableciendo así los inicios de la ingeniería genética (figura 5). El trabajo del Dr. Bolívar ha sido citado en el Web of Science en 5 mil 347 ocasiones, siendo hasta la fecha una herramientas de trabajo de laboratorios de biología molecular. Se trató también de un parteaguas en la relación academia-industria, así como de la creación de empresas surgidas desde la academia. Es el caso de Genentech esencialmente creada por científicos, haciendo posible proyectos de investigación aplicada que iniciaron con la clonación del gen de la insulina. De acuerdo con Stephen Hall en el libro Invisible Frontiers (8), una vez abierta la opción de la ingeniería genética, se inicia una férrea competencia por lograr la producción de insulina humana por ingeniería genética.

Parte de esta competencia fue también descrita recientemente por Arthur Riggs (9), integrante del llamado Somatostatin Team (Figura 6). Este grupo se integró para intentar, antes que la insulina, clonar el gen de la hormona humana somatostatina, convencidos por Riggs de que, aunque sin potencial de mercado, al ser mucho más pequeña y menos compleja (una sola cadena de 14 aminoácidos), el éxito demostraría a los inversionistas la viabilidad de la tecnología; lo que hoy llamamos la prueba de concepto. El proyecto le había sido rechazado por los Institutos Nacionales de Salud (NIH por sus siglas en inglés), calificándolo de tan solo un “ejercicio académico” sin mérito práctico. La expresión en E.coli de un gen sintetizado químicamente para producir somastotina fue así el primer éxito de la Ingeniería genética (10).

Una vez con la experiencia y el financiamiento necesario, se inicia la carrera descrita por Hall, en la que participaron el grupo de Walter Gilbert en Harvard y la empresa Biogen, el grupo Rutter-Goodman en la Universidad de California, San Francisco (UCSF) y la empresa Eli Lilly, y el grupo también de la UCSF y el City of Hope National Medical Center, tanto con Genentech como Eli Lilly. La complejidad de la carrera queda de manifiesto con la presencia de dos grupos dentro de la misma universidad, la UCSF, además, ambos ligados con la misma empresa, Eli Lilly, la que como hemos visto inició y evolucionó a lo largo del siglo pasado asociada con la producción de insulina. Colaborando con estos grupos había desde luego un numeroso grupo de brillantes académicos, como Lydia-Villa-Komaroff, una investigadora de origen mexicano graduada en el MIT, quien en el grupo de W. Gilbert y empleando el pBR322 (Figura 7), logró expresar la proinsulina en E. coli (11). Una segunda opción de clonación consistía en la expresión de las dos cadenas que constituyen la insulina por separado y su posterior ensamblaje. A la larga, hacer un solo transgénico con el precursor de la molécula de insulina resultó más viable, por ser menos complejo y riesgoso.
En los inicios de la década de los 80, con el conocimiento y herramientas desarrolladas en conjunto con el grupo de la UCSF, convencido de que la ciencia en México no podía quedar al margen de los avances en Biología Molecular, del conocimiento de la célula y del ADN, ni del aprovechamiento de sus poderosas herramientas, Francisco Bolívar, con un grupo de pioneros crearon el Centro de Investigación en Ingeniería Genética y Biotecnología, hoy Instituto de Biotecnología (IBt) en la UNAM (Figura 8).

Créditos a la UNAM.




